Kanama ve Pıhtılaşma Bozuklukları
Prof. Dr. Reyhan DİZ KÜÇÜKKAYA
İstanbul Bilim Üniversitesi, İç Hastalıkları Anabilim Dalı, Hematoloji Bilim Dalı, İstanbul
HEMOSTAZ NASIL SAĞLANIR?
Normal şartlarda kan hücreleri kemik iliğindeki yapım evresinden, retiküloendotelyal sistemde fagosite edildiği ana kadar, endotel ile kaplı alanlarda hareket ederler. Bu durum damarın açık kalmasını ve kan akımının devamını sağlar. Damarda kanın akışı bazı fizik prensiplere dayanmaktadır. Damarın büyüklüğüne göre değişmekle beraber kan akımının etkisiyle, damarın ortasında akım hızı yüksektir. Akım hızı damarın duvarına doğru yavaşlar. Kandaki hücrelerin büyüklüğü farklıdır, büyüklük ile hız arasında bir ilişki vardır. Damarın orta tabakasında en hızlı bir biçimde, en büyük kan hücreleri olan lökositler hareket ederler, yanlarda eritrositler yer alır. Damar duvarına en yakın bölgede, en yavaş seyreden, en küçük hücrelerden oluşan tabakayı trombositler oluşturur (1,2).
Damarların içi endotel adı verilen tek katlı bir yassı epitel ile örtülüdür. Endotel, damarın cidarında bulunan lifsel proteinlerin kan hücreleriyle temasını engelleyen önemli bir fizik bariyerdir. Endotel oldukça aktiftir, değişik uyaranlarla yüzeyinde eksprese edilen yüzey adezyon moleküllerinin profili sürekli değişir. Bu değişim kan içindeki düzenleyici proteinlere ve hücrelere sinyal iletilmesini sağlar. Endotel salgıladığı heparin benzeri maddeler sayesinde yüzeyinde pıhtılaşma proteinlerinin aktive olmasını engeller, bu durum damarın açık tutulmasını sağlar (1,2).
Von Willebrand faktör (vWF) endotelde ve megakaryositlerde büyük multimerler halinde sentezlenir. Endotelde Weibel Pallade cisimciklerinde depolanır. Endotel tarafından subendotelyal yüzeye bırakılan büyük vWF multimerleri trombositlerin adezyonunda görev alır. Plazmaya geçen vWF bir metalloproteinaz (ADAMTS-13) ile parçalanır, ortaya çıkan subunitler kanda faktör VIII'i taşır. vWF hem primer, hem de sekonder hemostazda görev alır. Ağır eksikliklerinde trombositlerin endotel altındaki dokulara yapışması bozulduğu gibi, kanda faktör VIII taşınamayacağından hemofili A benzeri kanama bulguları ortaya çıkabilir (3).
Herhangi bir nedenle endotel bütünlüğünü kaybederse endotel altı lifsel yapı ve buna bağlı vWF'ün açığa çıkması trombosit adezyonuna ve ardından agregasyona neden olur. Bu süreç "primer hemostaz" olarak adlandırılır. Bu arada açığa çıkan doku faktörünün pıhtılaşma sistemini etkilemesiyle trombositlerin etrafında fibrin ağı meydana getirilir. Trombüs kitlesi sabitleştirilip damar duvarına yapıştırılır. Pıhtılaşma sisteminin aktivasyonuyla oluşan bu sürece "sekonder hemostaz" adı verilir. Hemostaz primer ve sekonder hemostazın ardışık ve tamamlayıcı etkileşimiyle gerçekleşir. Primer hemostazda trombositler, vWF ve damar yapısı; sekonder hemostazda pıhtılaşma faktörleri görev yapar (1,2,3).
TROMBOSİTLER
Trombositler, kemik iliğinde megakaryosit adı verilen çok çekirdekli dev hücrelerin sitoplazmasından oluşur. Ortalama yaşam süreleri 10 gündür. Kanın hücresel elemanlarından biri olarak tanımlanmalarına rağmen, aslında gerçek anlamda bir hücre değildir, nükleusları yoktur. May-Grünwald-Giemsa ile boyanmış periferik yayma ışık mikroskobunda incelendiğinde trombositler mavi-gri renkte izlenir. Normalde sayıları 150.000-400.000/mm3'tür. Şekilleri yuvarlak veya ovaldir. Büyüklükleri yaklaşık 1.5-3 µm'dir. Arada daha iri trombositler bulunabilir. Periferik yaymada trombositlerin kümeler oluşturması sayısı ve kısmen fonksiyonları hakkında önemli ipuçları verir. Bu nedenle periferik yaymanın kan sayım tüplerinden alınan kanla değil, hastanın parmak ucundan alınan bir damla kan ile yapılması gerekir. Işık mikroskobu ile incelendiğinde 10 ve daha fazla trombositten oluşan kümeler görüldüğünde kabaca trombosit sayısının 100.000/ mm3'ün üzerinde olduğu kabul edilir (4).
Aktive olmamış (resting) trombositler diskoid şekildedir. Elektron mikroskobuyla incelendiğinde trombositlerin plazma membranının üç katlı yapısı dikkat çekicidir. Bu yapı kolesterol, glikolipid ve glikoproteinlerden zengindir. Trombosit içeriğindeki fosfolipidlerin yarısından fazlası membranın iç yüzeyinde yer alır. Trombosit aktivasyonu sırasında fosfolipidler trombosit yüzeyine geçer ve koagülasyon sisteminin önemli basamaklarının gerçekleşmesi için fosfolipidden zengin bir yüzey oluşturur. Plazma membranı içeriye doğru katlanarak kanallar oluşturur (açık kanaliküler sistem).
Trombositlerde nükleus yoktur. Ancak içinde peroksizomlar, mitokondria, lizozomlar ve değişik renkte ve büyüklükte granüller (alfa granülleri ve dense granüller) bulunur. Alfa granüllerinde trombosit faktör 4, beta-tromboglobulin, trombosit kaynaklı büyüme faktörü (PDGF), fibrinojen, trombospondin, plazminojen aktivatör-inhibitör 1, vWF, P-selektin ve glikoprotein IIb-IIIa reseptörü yer alır. Dense granüllerde ise serotonin, ATP, ADP, kalsiyum, pirofosfat ve histamin bulunur. Granüllerde depolanan bu maddeler, hemostaz, inflamasyon, vasküler tonus, fibrinoliz ve yara iyileşmesinde rol oynar (4).
Eğer endotelin bütünlüğü bozulursa, endotel altında bulunan kollajen, fibronektin, laminin gibi lifsel yapılar açığa çıkar. Özellikle kan akım hızının yüksek olduğu bölgelerde GPIb-V-IX kompleksinin subendotelyal lifler ve buna bağlı vWF'ye bağlanmasıyla trombositler endotel altındaki dokulara yapışmaya başlarlar. GPIb-V-IX kompleksinin vWF ile yaptığı bağlanma hızlı birleşme ve ayrılma şeklindedir. Bu trombositlerin endotel üzerinde hızlarının azalmasına neden olur. Yavaşlayan trombositler iki önemli kollajen reseptörü GPVI ve GpIa-IIa (integrin alfa2beta1) ile endotel altındaki dokulara sıkıca bağlanır ve adezyon tamamlanır. Adezyon trombosit içine sinyaller gitmesine neden olur ve trombosit aktive olur. Aktivasyon sırasında trombosit içeriğindeki vazoaktif ve trombo-stimülan maddeleri dışarı boşaltır, şekil değiştirerek yalancı ayakçıklar (psödopodlar) şeklinde uzantılar yapar, membranını negatif yüklü fosfolipidlerden zengin hale getirir ve yüzeyinde yeni reseptörler eksprese eder. Aktivasyondan sonra yüzeyde yer alan GPIIb-IIIa reseptörü, fibrinojen aracılığıyla trombositlerin birbirlerine yapışmasını (agregasyonu) sağlar. Sonuçta oluşturulan trombosit tıkacı ile primer hemostaz sağlanmış olur. Aktivasyon sonrası yüzeyde eksprese edilen P-selektin lökositler, monositler ve bunlardan kaynaklanan mikroveziküllerde bulunan PSGL-1 ligandı ile birleşir; doku faktörü salınımına neden olur. Böylece koagülasyon sistemi aktive edilir (1,2,3,4).
TROMBOSİT HASTALIKLARI
Trombositlerin sayısını ve fonksiyonlarını azaltan hastalıklar kanama eğilimine, artıran durumlar ise tromboz eğilimine neden olacaktır.
Trombosit sayı ve fonksiyonlarının bozulması primer hemostaz tipi kanamaya neden olur. Kanamalar travmadan hemen sonra meydana gelir (erken kanama). Cilt içinde kırmızı mor döküntüler (purpura) ve mukozal kanamalar (diş eti ve burun kanaması, menoraji gibi) tipiktir. Purpura eğer nokta nokta cilt kanaması şeklinde ise "peteşi", daha geniş mor alanlar şeklinde olursa "ekimoz" adını alır. Ağır trombositopenik hastalarda ağız içinde hemorajik büller görülebilir. Trombositopenik hastalarda purpura ciltten kabarık değildir (palpe edilemez). Başlangıçta kırmızı- mordur, zamanla yeşil-sarı renk alır ve ciltte pigmentasyon bırakmadan kaybolur.
Trombosit sayısı oluşturulacak primer tıkacın boyutunu belirleyen en önemli parametre olduğundan, primer hemostazın değerlendirilmesinde trombosit sayısı önemlidir. Otomatik kan sayım cihazlarındaki değerler klinik ile örtüşmüyorsa, mutlaka parmak ucundan yapılacak periferik yayma ile doğrulanmalıdır. Trombosit sayısı in vivo normal olduğu halde hemogramda trombositopeni görülmesi "yalancı trombositopeni" olarak adlandırılır. Periferik kanda dev trombositlerin olması, EDTA'ya bağlı aglütinasyon, trombosit satellitizmi (trombositlerin rozet şeklinde nötrofillere bağlanması) ve GPIIb-IIIa antagonistlerinin kullanılması yalancı trombositopeni yapan nedenlerin başında yer almaktadır (4).
Trombosit sayısının 100.000- 150.000/mm3 arasında olmasının hemostaz açısından önemli bir klinik veya laboratuvar yansıması yoktur. Trombosit sayısı < 100.000/mm3 olduğunda travma sonrası uzamış kanama görülebileceğinden elektif cerrahi girişimler sırasında trombosit sayısının > 100.000/mm3 olması istenir. Eşlik eden başka bir hastalık yoksa 70.000-80.000/mm3 ve üzerindeki değerlerde doğuma (vaginal veya sectio ile) ve solid organ biyopsilerine izin verilebilir. Trombosit sayısı < 50.000/mm3olduğunda çabuk morarma başlar, < 30.000/mm3 olduğunda spontan kanama görülebilir, < 10.000/mm3 olduğunda hayatı tehdit edecek kanama riski çok yüksektir (4).
Trombosit sayısının yeterliliği yanında fonksiyonlarının da iyi olması gereklidir. Trombosit fonksiyonlarını ölçmek için kanama zamanı testi (Duke testi, IVY testi), trombosit agregasyon testleri (agonist ile agregasyon, PFA-100), tromboelastografi, trombosit yüzey reseptörlerinin akım sitometri yoluyla değerlendirilmesi, trombosit salınım fonksiyonlarının ölçülmesi gibi değişik testler kullanılmaktadır.
TROMBOSİTOPENİYE NEDEN OLAN HASTALIKLAR
Trombositopeniye neden olan hastalıklar uzun bir liste oluşturur (Tablo 1). İlk değerlendirmede hastanın anamnezi, aile öyküsü, kullanmakta olduğu ilaçlar ve klinik muayene bulguları çok önemlidir. Çocukluk çağından itibaren kanama bulguları olan veya aile öyküsü olan hastalarda konjenital sebepler araştırılmalıdır. Ateş, terleme, kilo kaybı gibi şikayetlerin varlığında infeksiyonlar ve maligniteler akla gelmelidir. Fizik muayenede purpura yanında iskelet anomalileri, splenomegali, hepatomegali, lenfadenomegali araştırılmalıdır. Periferik yaymada trombosit morfolojisi, küme oluşturması, lökosit ve eritrositlerdeki değişiklikler ve anormal hücreler dikkatle incelenmelidir. Periferik yaymada iri trombositler varsa, makrotrombosit yapan hastalıklar veya trombosit yapım hızının arttığı (örneğin immün trombositopenik purpura) durumlar araştırılmalıdır.
Konjenital Trombositopeniler
MYH9- ile ilişkili hastalıklar: MYH9 geninde gelişen mutasyonlar May Heglin anomalisi, Fechtner sendromu, Ebstein sendromu ve Sebastian sendromuna neden olur. Bu hastalıklar otozomal dominant geçer, genin kodladığı miyozin ağır zinciri trombositler, lökositler, koklea ve böbreklerde bulunur. Mutasyonun yeri ve şiddetine göre klinik bulgular değişir. Hastalarda makrotrombositler, trombositopeni, lökositlerde Döhle cisimciğine benzer inklüzyonlar, işitme bozuklukları, nefrit, katarakt görülebilir. Kanama genellikle hafiftir (4,5).
Bernard-Soulier hastalığı: GP Ib-V-IX kompleksinde gelişen mutasyonlar sonucu oluşan, otozomal resesif bir hastalıktır. Trombositlerin adezyon yeteneği bozulmuştur. Doğumdan itibaren kanama bulguları vardır. Hafif trombositopeni (50.000-100.000/mm3) vardır, periferik yaymada dev trombositler görülür. Trombosit agregasyon testleri yapıldığında ristosetin ile agregasyonun bozulduğu; ADP, epinefrin ve kollagen ile agregasyonun normal olduğu izlenir. Akım sitometrisi ile reseptörün ekspresyonunda azalma/kaybolma gösterilmesi tanı koydurucudur (6).
Glanzmann trombastenisi: GP IIb-IIIa reseptöründe mutasyon sonucu oluşan otozomal resesif geçişli bir hastalıktır. Doğumdan itibaren kanama bulguları mevcuttur. Bu hastalarda trombosit sayısı ve morfolojisi normaldir, ancak yaymada küme görülmez. Agregasyon testlerinde ristosetinle agregasyon normaldir; ADP, kollagen ve epinefrin ile agregasyon bozulmuştur. Pıhtı retraksiyonu olmaz. Akım sitometrisi ile GPIIb-IIIa reseptörünün kantitatif değerlendirmesi yapılır (7).
Ailevi Akdeniz makrotrombositopenisi: Otozomal geçişli bir hastalıktır. Hafif trombositopeni yapar. Periferik yaymada dev trombositler vardır. Kanama eğilimi yapabilir (5).
Von Willebrand hastalığı (vWH): vWF geninde oluşan mutasyonlar vWH'ye neden olur. Bu hastalık aslında toplumda sıktır (%1), ancak hastaların sadece %10'unda kanama bulguları görülür, bunların da büyük bir kısmı atlanmaktadır. Hastalığın 3 tipi vardır. Tip1 vWH'li olguların %75-80'ini oluşturur, vWF yapısal olarak normaldir, ancak miktarı azalmıştır. Tip2 hastalıkta kalitatif defekt mevcuttur, 4 ayrı altgrup vardır: Tip2A'da multimerlerin kesilme noktasındaki mutasyon vardır. Metalloproteaz ile kesilme hızlanır. Tip2B'de trombosite bağlanma noktasında mutasyon mevcuttur, anormal vWF multimerleri trombositlere bağlanarak trombositopeniye neden olur. Tip2M nadirdir, vWF A1 parçasındaki mutasyonlarla olur. Multimer dağılımı normal olduğu halde trombositlere ve FVIII'e bağlanma bozuktur. Tip2N'de trombositle ilişkili vWF fonksiyonları normaldir, FVIII'e bağlanma bozulmuştur. Tip3 son derece nadirdir, vWF hemen hemen hiç yapılamaz. Sonuçta FVIII de taşınamayacağından hemofili A'ya çok benzer. Kanama bulguları ağırdır (3).
İmmün Trombositopeniler
İdiopatik Otoimmün Trombositopenik Purpura (İTP): Trombosit glikoproteinlerine karşı oluşan otoantikorların neden olduğu edinsel bir hastalıktır. İTP çocuklarda sıklıkla akut olarak başlar, genellikle trombositopeni ağırdır, birkaç hafta içinde kendiliğinden düzelir, nadiren kronikleşir. Oysa erişkinlerde genellikle sinsi başlar, kronik seyreder, kadınlarda daha sıktır, spontan düzelme nadirdir. Olguların yaklaşık %80'inde otoantikorlar GP IIb-IIIa kompleksine bağlanır. Antikor ile kaplı trombositler başta dalak olmak üzere retikülendotelyal sistemde antijen-sunan hücrelere Fc reseptörleri yoluyla bağlanır. Trombositlerin yıkılması immün yanıtın şiddetlenmesine neden olur. Antijen-sunan hücreler trombosit antijenleri ile aktive olduğunda hem CD4-pozitif T hücre klonlarını, hem de antijen-spesifik T hücre klonlarını aktive eder. Bu farklı antijenlere spesifik T hücre klonları, farklı B hücre klonlarının aktivasyonuna neden olur. Böylece hastaların büyük bir kısmında spesifik bir hedef antijen ile başlayan immün reaksiyon, diğer trombosit antijenlerine karşı oluşan antikorlarla katlanarak devam eder. Trombosit sayısı azalınca kemik iliği yapımı artırarak yanıt verir. Genellikle İTP hastalarında kemik iliğinde megakaryosit sayısı normal veya artmıştır. Bununla birlikte oluşan antikor megakaryositlerde de paylaşılan bir antijene yönelik ise kemik iliğinde megakaryosit sayısı azalmış bulunabilir. Son yıllarda bazı hastalarda megakaryositlerden trombosit yapımının da defektli olduğu gösterilmiştir.
Trombositopeninin şiddeti semptomları belirleyen en önemli unsurdur. Bu arada hastanın ek hastalıklarının olması (üremi, aspirin veya anti-inflamatuvar ilaç kullanımı, karaciğer yetersizliği gibi) kanamaların şiddetini artıracaktır. Trombosit sayısı 30.000/mm3'den az olan hastalarda purpura belirgindir. Hematüri, hemoptizi ve gastrointestinal kanama daha seyrektir. İntrakraniyal kanama nadirdir ve genellikle trombosit sayısı 10.000/mm3'den az olan hastalarda görülmektedir. Ağız mukozasında hemorajik büller görülmesi trombositopeninin ağır olduğunu işaret eden önemli bir bulgudur.
İTP tanısında spesifik bir laboratuvar yöntemi yoktur, bu nedenle tanıda trombositopeni yapan diğer nedenlerin dışlanması çok önemlidir. Kanama bulguları dışında anamnez ve klinik muayene normal olmalıdır. Konstitüsyonel semptomların (ateş, kilo kaybı gibi) ve belirgin organomegalinin varlığı İTP tanısından uzaklaştırır, böyle olgularda mutlaka diğer hastalıklar aranmalıdır. Ailede trombositopeni mutlaka sorgulanmalıdır. Laboratuvar incelemesinde izole trombositopeni tipiktir. Yaymada arada dev trombositler görülebilir. Hemoglobin konsantrasyonu ve hematokrit genellikle normaldir. Aşırı kanama bulguları olan olgularda demir eksikliği anemisi olabilir. Bazen Coombs-pozitif otoimmün hemolitik anemi İTP'ye eşlik edebilir (Evans sendromu).
İTP kılavuzlarında 60 yaşın altında, tipik prezentasyonu olan, ilk basamak tedaviye iyi yanıt veren veya splenektomi düşünülmeyen olgularda ilk değerlendirmede kemik iliği incelemesi önerilmemektedir. Bununla beraber bazı hematologlar özellikle çocuklarda ve 40 yaş üstündeki erişkinlerde miyelodisplazi ve lösemi ayırıcı tanısının yapılabilmesi için kemik iliği biyopsisi gerektiğini savunmaktadırlar.
ITP tedavisinin komplikasyonları önemli sonuçlar doğurabileceğinden, tedavi kararı verirken çok dikkatli olmalıdır. Trombosit sayısı 50.000/mm3'ten fazla olan ve kanama bulguları olmayan olgularda tedaviye gerek yoktur ve güvenle takip edilebilir. Trombosit sayısı 30.000/mm3 altında olan olgularda, trombosit sayısı 30.000- 50.000/mm3 arasında olup kanama bulguları olanlarda veya kontrolsüz hipertansiyon ve peptik ülser gibi kanama riskini artıracak hastalığı olanlarda tedavi gerekir. Eğer İTP'li bir olguda intrakraniyal kanama, gastrointestinal kanama, masif hematüri veya internal hematom varsa bu olgular mutlaka hastaneye yatırılmalı ve acil olarak trombosit sayısı yükseltilmelidir. Genellikle acil tedavide parenteral glukokortikoid tedavi (metil prednizolon 1 g/gün, 3 gün), IVIg (1 g/kg/gün, 2 gün) veya IVIg + parenteral glukokortikoid birlikte verilir. Akut kanaması olmayan olgularda genellikle başlangıç tedavisinde oral prednizon (1-2 mg/kg/gün) başlanır. Glukokortikoidler otoantikor yapımını azaltır, makrofajların fagositoz yeteneğini bozar, kemik iliğinde trombosit yapımını artırır ve kapiller sızmayı engeller. İTP'de başlangıç tedavisinde dört günlük yüksek doz deksametazon tedavisi de kullanılabilir. Sonuçta hangi doz uygulanırsa uygulansın, glukokortikoidlerle elde edilen kalıcı cevabın %5-30 arasında değiştiği bilinmektedir. Steroide cevapsız İTP hastalarında splenektomi önerilir. Splenektomiye hazırlanırken mutlaka kemik iliği incelenip başka bir patoloji olmadığı gösterilmelidir. Hastalar splenektomiden en az 10 gün önce kapsüllü bakterilere karşı aşılanmalıdır (pnömokok, meningokok ve hemofilus influenza aşıları). Splenektomi laparoskopik veya açık yapılabilir. Genellikle splenektomiden hemen sonra saatler içinde trombosit sayısı normale döner. Olguların %20'sinde splenektomi başarısızdır. Bu olgularda belli bir tedavi algoritması yoktur; klinik bulgular, yaş, trombosit sayısı, hastanın yaşam tarzı ve eşlik eden hastalıklara göre bir tedavi şekli oluşturulur. Eğer hastada kanama riskini artıracak bir durum yoksa, trombosit sayısı 30.000/mm3 üstünde olan olgular tedavisiz izlenir. Splenektomi sonrası trombosit değeri 30.000/mm3 altında olanlarda veya kanama bulguları olanlarda anti CD-20 monokonal antikorları (rituksimab), vinkristin, anti-(Rh)-D antikorları, azatioprin, danazol, siklosporin, siklofosfamid denenebilir. Son yıllarda trombopoietin reseptörünü uyaran (trombopoietin-mimetik) ilaçlar ile trombosit sayısının artırılabileceği gösterilmiştir. Etkileri geçicidir, tromboz ve kemik iliği fibrozu riski olduğundan kısa süreli kullanım için onay almışlardır (4).
Allo-immün trombositopeni: Yenidoğanda anneden geçen anti-trombosit antikorları trombositopeniye neden olabilir (neonatal alloimmün trombositopeni). Çok transfüzyon yapılmış kişilerde trombosit antijenlerine karşı oluşan antikorlar, trombositopeniye yol açabilir (post-transfüzyon purpura) (4).
Trombotik mikroanjiyopatiler (TMA): TMA çeşitli organları tutan, mikrodolaşımda trombosit tıkaçlarının oluşmasıyla karakterize bir durumdur. Trombotik trombositopenik purpura (TTP, Moschowitz sendromu) ve hemolitik üremik sendrom (HÜS) tipik örnekleridir. TTP, von Villebrand faktörü parçalayan ADAMTS-13 adlı metalloproteinaz enziminin eksikliği sonucu gelişir. ADAMTS-13 geninde oluşmuş konjenital mutasyonlar, otoantikorlar ve bazı ilaçların kullanımı ADAMTS-13 eksikliğine neden olabilir. ADAMTS-13 eksikliğinde vWF kesilemez, kanda oldukça büyük multimerler şeklinde dolaşır ve endotelin üzerinde uzun zincirler oluşturur. Trombositlerin bu uzun von Willebrand multimerlerine bağlanması ile küçük damarlarda trombosit tıkaçları meydana gelir. Buradan geçmekte olan eritrositler mekanik olarak parçalanır. Bu tıkaçlar başlıca merkezi sinir sitemi ve böbreklerde fonksiyon bozukluklarına yol açar, venöz ve arteryel aşikar tromboz eşlik edebilir. Hastalığın pentadı; trombositopeni, mikroanjiyopatik hemolitik anemi, böbrek yetersizliği, dalgalanan nörolojik bulgular ve ateştir. TTP tanısında periferik kanda fragmante eritrositlerin (şistositler) görülmesi, LDH yüksekliği, retikülositoz yanında koagülasyon testlerinin normal oluşu tipiktir. Direkt anti-globulin (Coombs) testi negatiftir. Tedavide eksik olan ADAMTS-13 enzimini yerine koymak ve anti-ADAMTS-13 antikorlarını uzaklaştırmak için plazma değişimi tedavisi yapılır. Beraberinde glukokortikoid verilir. Refrakter olgularda splenektomi uygulanır, vinkristin denenebilir. Trombosit değeri ne olursa olsun, trombosit transfüzyonu yapılması kontrendikedir. Ancak hayatı tehdit eden ağır kanama söz konusu ise trombosit transfüzyonu gündeme gelebilir (3,8,9).
HÜS, mikroanjiyopatik hemolitik anemi, trombositopeni ve böbrek fonksiyon bozukluğu ile karakterizedir. TTP'den başlıca klinik farkı nörolojik bulguların olmamasıdır. Olguların %90'ı çocuktur ve ishal ile ilişkilidir (tipik HÜS, D+ HÜS). Bu olgularda enterohemorrhagic Escherichia coli, Shigella dysenteriae, Citrobacter, Streptococcus pneumoniae gibi Shiga-toksin veya vero-toksin üreten mikroorganizmaların neden olduğu kanlı ishallerin arkasından (2-14 gün sonra) HÜS gelişir. Olguların çoğunda destek tedavisi (eritrosit transfüzyonu ve gerekirse diyaliz) ile iyileşme sağlanır. İshal ile ilişkili olmayan (atipik HÜS, D- HÜS) sinsi başlar, relapslarla seyreder ve ciddi böbrek fonksiyon bozukluğuna yol açar. Atipik HÜS kompleman düzenleyici proteinlerde edinsel veya konjenital eksiklik sonucu meydana gelmektedir. Faktör H, faktör I ve membran kofaktör proteini mutasyonları veya bunlara karşı oluşan antikorlar anormal kompleman aktivasyonuna yol açarak HÜS gelişimine neden olmaktadır (8,9).
Tüketim koagülopatisi veya yaygın damar içi pıhtılaşması sendromu infeksiyonlar, maligniteler, kemoterapi ve radyoterapi sırasında ortaya çıkan ağır bir durumdur. Endotel hasarı ve aşırı trombin oluşumuyla karakterizedir. Tüketim koagülopatisinde TMA'dan farklı olarak, aşırı fibrin oluşumu mikrodolaşımda trombüslere neden olur. Trombüslere çarpan eritrositlerin yıkılması hemolitik anemi ve periferik yaymada fragmante eritrositlerin görülmesine neden olur. Aşırı trombosit tüketilmesi trombositopeniyle sonuçlanır. Koagülasyon faktörlerinin aşırı kullanılması protrombin zamanı ve aktive parsiyel tromboplastin zamanını uzatır, fibrinojen azalır, fibrin yıkım ürünleri artar. Değişik organların mikrotrombüslerle hasarı sonucu böbrek yetersizliği, erişkin sıkıntılı solunum sendromu, karaciğer yetersizliği ve nörolojik bulgular gelişebilir. Tedavide tüketim koagülopatisine neden olan durumun (gram-negatif sepsis, malignite vb.) tedavisi ve destek tedavisi (trombosit, eritrosit ve taze dondurulmuş plazma transfüzyonları) uygulanır. Büyük damar trombozları gelişen olgularda antikoagülan tedavi kullanılabilir.
Trombositlerin Anormal Dağılımı
Splenomegali ve hipersplenizm: Dalak sol hipokondriumda yer alır. Orta koltuk altı çizgisinde 9.-11. kostalar arasında perküte edilir. Vücudun en büyük lenfoid organıdır. Ağırlığı erişkinde 100-200 gram arasındadır. Vücuttaki kanın yaklaşık 1/3'ü dalakta sekestre edilir, acil durumlarda bu kan sirkülasyona yardımcı olur. Dalağı büyüten hastalıklarda sekestre edilen kan miktarı artar, hafif-orta derecede değişen sitopeniler (izole trombositopeni, bisitopeni, pansitopeni) izlenir. Viral hepatitlerin endemik olduğu ülkelerde en sık trombositopeni nedeni portal hipertansiyona bağlı hipersplenizmdir. Hipersplenizmde görülen trombositopeni bazen kronik İTP ile karışabilir. Her ikisinde de kemik iliği aspirasyonunda megakaryosit bol bulunur. Fizik muayenede kronik karaciğer hastalığına ait bulguların (sarılık, splenomegali, asit, telenjiektazi, arteryel örümcek gibi) bulunması, batın ultrasonografisinde splenomegali ile birlikte portal sistemde basınç artışı bulgularının olması hipersplenizm tanısında önemlidir (4,10).
Ağır hipotermi geliştiğinde (< 25°C) veya kardiyovasküler cerrahi sırasında ekstra-korporeal soğutma uygulandığında trombosit sayısı azalabilir. Hayvan deneylerinde aşırı soğuk uygulandığında trombositlerin dalakta ve karaciğerde sekestre edildiği, ısıtma sonrası tekrar dolaşıma katıldığı gösterilmiştir (4).
Masif kan transfüzyonu: Eğer bir hastaya 24 saat içinde total kan volümü kadar kan transfüzyonu gerekiyorsa, üç saat içinde total kan volümünün yarısı kadar kan transfüzyonu gerekiyorsa veya bir saat içinde dört ünite ve daha fazla transfüzyon gerekiyorsa masif kan transfüzyonu olarak kabul edilmektedir. Bu sırada verilen kan ürünlerinde trombosit miktarı düşük olacağından, dilüsyonel trombositopeni gelişir. Masif transfüzyonun en önemli komplikasyonları arasında sayılan hipotermi, asidoz ve koagülopati trombositopeniyi ağırlaştırabilir (4).
Gebelikle ilişkili trombositopeni: Gebelikte trombositopeni sık karşılaşılan bir durumdur (Tablo 2).
Gebelerin yaklaşık %5-7'sinde herhangi bir patolojik durum olmadığı halde trombosit değeri ikinci trimestırdan itibaren azalabilir. Gestasyonel trombositopeni olarak adlandırılan bu durumda trombosit değeri genellikle 70.000/mm3'ün üzerindedir, kanama riski yoktur, bebekte trombositopeniye yol açmaz. Etyopatogenezde hemodilüsyon, endotel hasarı, plasentanın trombositleri tüketmesi, gebelik sırasında megakaryopoezin depresyonu suçlanmaktadır. Doğumdan hemen sonra normale döner. Gebelikte eğer birinci trimestırdan itibaren izole trombositopeni varsa ve trombosit değeri herhangi bir trimestırda < 50.000/mm3 oluyorsa, öncelikle İTP düşünülmelidir.
Gebelikte hipertansiyon ve proteinüri olması pre-eklampsi, bu tabloya nörolojik bulguların eklenmesi eklampsi olarak tanımlanır. Pre-eklampsi olgularının yarısında trombositopeni vardır. Pre-eklampsinin şiddetiyle trombositopenin şiddeti doğru orantılıdır. HELLP sendromu (hemoliz, karaciğer fonksiyon testlerinin yükselmesi, trombositopeni) gebelikte görülen bir mikroanjiyopatik hemolitik anemidir. TTP'ye klinik ve laboratuvar olarak benzer, ancak TTP'de nörolojik tutulum yerine, karaciğer tutulumu belirgindir. Pre-eklampsi, eklampsi ve HELLP sendromu annenin hayatını tehdit eden durumlardır, mortalite yüksektir. En etkili tedavi hemen doğumun gerçekleştirilmesidir (4).
TROMBOSİTOZ YAPAN DURUMLAR
Trombosit sayısının > 450.000/mm3 olması trombositoz olarak tanımlanmaktadır. Trombosit sayısının çok arttığı durumlarda arteryel ve venöz tromboz riski artmaktadır. Ancak trombosit sayısının artışı bazen yapım kusuru ile birlikte olabilmektedir, bu olgularda kanama bulguları görülebilir. Trombositoza neden olan durumlar başlıca üç grupta toplanır: ailevi (familyal) nedenler, reaktif trombositoza yol açan durumlar ve klonal tromboz yapan hastalıklar.
1. Ailevi (familyal) trombositoz: Trombopoietin genindeki spesifik mutasyonlar ailevi trombositoza neden olabilmektedir. Genellikle otozomal dominant geçer. Oldukça nadirdir. Ailede birden fazla bireyde trombositoz olması dikkat çekicidir. Klinik bulguları heterojendir.
2. Reaktif trombositoz: En sık rastlanan trombositoz nedeni aslında reaktif trombositozdur. Akut kan kaybı, akut infeksiyon, akut veya kronik inflamasyon (inflamatuvar bağırsak hastalığı, tüberküloz vb), demir eksikliği anemisi, hemolitik anemi, splenektomi, maligniteler, kemoterapi veya radyoterapiye bağlı kemik iliği depresyonunun iyileşme dönemi, ağır egzersiz, cerrahi girişim ve çeşitli ilaçların kullanımı (vinkristin, adrenalin, sitokinler) reaktif trombositoza neden olabilirler. Reaktif trombositozda trombosit artışı genellikle akut faz cevabı ile ilişkilidir. Neden olan tablo ortadan kalkınca veya remisyona girince trombositoz da geriler veya kaybolur. Reaktif trombositozda trombosit sayısı 1.000.000/mm3'e kadar çıkabilmektedir, bu nedenle klonal trombositozdan ayırmak kolay değildir.
3. Klonal trombositoz: Kronik miyeloproliferatif hastalıklarda (kronik miyeloid lösemi, polisitemia vera, esansiyel trombositemi, idiyopatik miyelofibroz) trombositoz önemli bir bulgulur. Kronik miyeloproliferatif hastalıkları periferik kan bulguları ve kemik iliği inelemesi ile ayırmak her zaman mümkün değildir. Kronik miyeloid lösemi tanısında Philadelphia kromozomunun (9 ve 22. kromozomlar arasındaki translokasyon) ve bunun ürünü olan BCR-ABL onkogeninin gösterilmesi şarttır. Kronik miyeloid lösemi dışındaki miyeloproliferatif hastalıkların tanısında ise fizik muayene, periferik kan ve kemik iliği bulgularına göre tanı konulmaktadır. Eritroid dizide artışın ön planda olduğu durumlarda polistemia vera, kemik iliğinde fibrozun arttığı durumlarda idiyopatik miyelofibroz tanısı konulmaktadır. Esansiyel trombositemi trombosit sayısında aşırı yükselme ile seyreder. Tanı için reaktif nedenlerin dışlanması gereklidir. Kemik iliğinde megakaryosit kümelerinin görülmesi ve fibroz varlığı esansiyel trombositemiyi kuvvetle destekler. Ancak, bu bulguların hiçbiri spesifik değildir. Bu nedenle klonal trombosit artışı ile reaktif trombositozu ayırmak güçtür. 2005 yılında tanımlanan JAK2 (Janus kinaz 2) V617F mutasyonu miyeloproliferatif hastalıkların tanısında önemli bir belirteç olmuştur. Bu mutasyon polisitemia veralı hastaların %95'inde, esansiyel trombositemili hastalar ve idiyopatik miyelofibrozlu hastaların %50'sinde bulunmaktadır. Geri kalan hastalarda farklı JAK ve MPL mutasyonları da tarif edilmektedir. JAK2 V617F mutasyonu sekonder polisitemi ve reaktif trombositozda görülmez. Trombositozu olan olgularda JAK2 V617F mutasyonu ile olguların yaklaşık yarısında klonal trombositoz olduğu gösterilebilmektedir. Diğer olgularda kemik iliği biyopsi bulgularıyla tanı konmaya çalışılmaktadır (11).
PIHTILAŞMA SİSTEMİ
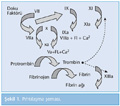
1960'lı yılların başında ilk kez şelale modeliyle tanımlanmaya çalışılan pıhtılaşma sistemi, her faktörün ardışık olarak birbirini aktiflediği bir dizi reaksiyonla açıklanmıştı. O dönemde tüm çalışmalar in vitro şartlarda yapılmaktaydı, biyokimyasal teknikler plazmada düşük miktarlarda bulunan koagülasyon maddelerini ölçmede yetersizdi. İlk çalışmalarda pıhtılaşma sisteminin iki farklı yoldan aktive olabileceği gösterildi: ekstrensek yol (doku faktörünün FVII aktivasyonu ile başlayan yol) ve intrensek yol (FXII aktivasyonu ile başlayan yol) (Şekil 1). Eğer kan tüpe alınırsa yabancı yüzeyin FXII'yi aktive etmesiyle intrensek yol başlamaktaydı. Oysa ekstrensek yolun başlaması için dışarıdan doku faktörü ilavesi gerekliydi. 1990'ların başında FVIIa'nın ayrı bir yolla FIX'i aktive edebildiği anlaşıldı. 1990'ların sonunda FXII eksikliği olan olgularda in vitro testler (aktive parsiyel tromboplastin zamanı) çok uzun bulunduğu halde, herhangi bir kanama problemi olmadığı gösterildi. FXII, prekallikrein ve yüksek molekül ağırlıklı kininojenin koagülasyonun inflamasyonla ilişkili bölümünde rol oynadığı anlaşıldı. 1990'lı yılların sonlarına kadar doku faktörünün sadece doku hasarı olduğunda açığa çıkabildiği düşünüldü. Biyokimyasal teknikler geliştikçe, kanda aslında eser miktarda doku faktörü olduğu, monosit ve nötrofillerde doku faktörü üretilebildiği gösterildi. 2000'li yılların başında ekstravasküler hücreler ve damar duvarı dışında, lökosit kaynaklı mikropartiküllerde doku faktörünün varlığı gösterildi. Böylece direkt olarak damar hasarı oluşmadan da kanda fibrin ağının oluşabileceği ispatlanmış oldu. Herhangi bir şekilde trombositler veya endotel hücrelerinin uyarılması ile P-selektin ekspresyonunun gerçekleştiği, P-selektinin lökositlerde ve lökosit kaynaklı mikroveziküllerde bulunan PSGL-1 ligandıyla bağlanması sonucunda doku faktörünün plazmaya geçtiği ve koagülasyon sisteminin aktive edildiği gösterildi (2,12).
Faktör XII eksikliği olan olgularda pıhtılaşma testleri uzun bulunduğu halde herhangi bir kanama bulgusu görülmemektedir. FXII inflamasyon-koagülasyon ilişkisinde rol oynamakla beraber in vivo koagülasyonda şart değildir. In vivo ortamda doku faktörü/FVII aktivasyonuyla oluşan trombin, faktör XI'i aktive ederek intrensek yolu başlatmaktadır (Şekil 1).
Koagülasyon sistemini, başlangıç, ilerleme ve fibrin oluşumu olarak üç faza ayrılabilir. Başlangıç fazında doku faktörü ve FVIIa kompleksi oluşmaktadır. İlerleme fazında bu kompleks hem direkt olarak FX'i aktifleyerek, hem de FIX üzerinden giden yolla protrombinden trombin oluşumunu sağlamaktadır. Son fazda fibrinojen fibrine çevrilmekte ve FXIII tarafından fibrin ağı oluşturulmaktadır (Şekil 1).
PIHTILAŞMA BOZUKLUKLARI
Pıhtılaşma sisteminde görev alan faktörlerin eksiklikleri veya fonksiyon bozuklukları kanama ve tromboz eğilimine neden olmaktadır. Edinsel veya kalıtsal nedenler pıhtılaşma bozukluklarına neden olabilir (Tablo 3).
PIHTILAŞMA SİSTEMİNİN LABORATUVAR TESTLERİYLE DEĞERLENDİRİLMESİ
Pıhtılaşma sisteminin değerlendirilmesinde kullanılan testler in vitro koagülasyon sisteminin aktivasyonu basamaklarına dayanır. Ekstrensek yolu değerlendiren protrombin zamanı testinde (PT), plazmaya doku tromboplastini eklenir. İnkübasyon ile fibrin ipliklerinin oluşma süresi ölçülür. İntrensek yolu değerlendiren aktive parsiyel tromboplastin testinde (aPTT) doku tromboplastininin bir parçası ve bir aktivatör (celite, kaolin gibi) kullanılır. Trombin zamanı ise ortak yolun aktivasyon hızını ölçmektedir. Taramada öncelikle PT, aPTT testleri kullanılır (Tablo 1). Bir bozukluk saptanırsa karışım testi, inhibitör tayini, fibrinojen miktarı, fibrin yıkım ürünleri, D-Dimer, spesifik faktör ölçümleri yapılarak patoloji ortaya konmaya çalışılır.
Pıhtılaşma testlerini uzatabilecek üç durum söz konusudur:
1. Spesifik bir faktörün/faktörlerin konjenital veya edinsel olarak yapılamaması,
2. Lupus antikoagülanı olması,
3. Faktör inhibitörünün olması.
PT veya aPTT testinde uzama olması için faktör aktivitesini %30'dan fazla azaltan bir patoloji olması gerekir. Bu nedenle PT ve/veya aPTT testi uzun olgularda "karışım testi" yapılarak bu üç durumdan hangisinin olduğu anlaşılmaya çalışılır. Karışım testinde hasta plazmasına eşit oranda normal plazma karıştırılır, 0-30-60 ve 120. dakikalarda PT/aPTT testleri okunur. Normal plazmada faktör aktivitesinin %80-100 olduğu düşünülecek olursa, karışımda en az %40-50 faktör aktivitesi sağlanacaktır. Faktör eksikliği olan olgularda karışımdan hemen sonra (0. dakika) test düzelir ve tüm inkübasyon sürelerinde normal kalır. Tanı spesifik faktör eksikliği gösterilerek konur. Toplumumuzda en sık hemofili A ve B (FVIII ve IX eksikliği) görülmektedir, diğer faktör eksiklikleri daha nadirdir. Faktöre karşı inhibitör varsa 0. dakikada düzelme olur, inkübasyon sırasında inhibitör antikorlar karışımdaki faktörlere bağlanarak onları etkisiz hale getirir. Antikor titresi ile ilişkili olarak test uzar. Tanı kanda ilgili faktörün aktivitesinin azaldığı gösterilerek ve inhibitör düzeyi ölçülerek konur. Lupus antikoagülanı varsa, fosfolipidlere karşı oluşmuş antikorlar test reaktifi içindeki fosfolipidlere bağlanacağından test 0. dakikadan itibaren uzun kalır. Lupus antikoagülanı tanısı, antikorların fosfolipid bağımlılığı gösterilerek (fosfolipid nötralizasyon testi) konur (13,14,15,16,17).
Eğer PT ve aPTT birlikte uzamışsa hastanın klinik tablosuna göre ön planda birden fazla faktörü ilgilendiren bir problem akla gelmelidir. Faktörlerin yapım bozukluğu (karaciğer yetersizliği, K vitamini eksikliği veya K vitamini antagonisti kullanımı), faktörlerin anormal tüketimi (yaygın damar içi pıhtılaşması sendromu), seyrek olarak ortak yol bozuklukları ve konjenital kombine faktör eksiklikleri düşünülmelidir. Karaciğer yetersizliğinin ilk dönemlerinde öncelikle PT uzaması gerçekleşir. Karaciğer yetersizliği ağırlaştığında bütün faktörlerin yapımı bozulur, aPTT de uzar. Yenidoğanda, uzun süre parenteral beslenen ve geniş spektrumlu antibiyotik kullanan olgularda K vitamini yetersizliğine bağlı faktör II, VII, IX ve X aktivasyonu bozulur; hem PT, hem de aPTT uzar. K vitamini antagonisti ilaçlar ve zehirler (warfarin, süper warfarinler) terapötik dozun üstünde K vitamini antagonizması yaparlarsa PT ve aPTT birlikte uzayabilir. Tanı FVIII aktivitesi normalken, K vitaminine bağımlı faktörlerin eksik olmasıyla konur. Yaygın damar içi pıhtılaşması sendromunda tüketime bağlı tüm faktörler ve trombositler azalır. Fibrinojen azalmış, fibrin yıkım ürünleri artmıştır. Periferik yaymada eritrosit fragmantasyonu tipiktir. Bazı olgularda ağır kanama bulgularına rağmen hemostaz testleri normal olabilir. Bu durumda öncelikle FXIII eksikliği düşünülmelidir. Son derece nadir olan bu durum (2-4 milyonda bir görülür) yara iyileşmesinde gecikme, göbek kordonundan kanama, travma ile veya spontan masif kanamalarla seyreder. Burada fibrin iplikçikleri oluşmakta, ancak birbirine bağlanamamaktadır. PT ve aPTT normaldir. Tanıda beş molar üre solüsyonunda pıhtı stabilitesinin ölçümü önemli bir ipucudur. FXIII düzeyini ölçen testler rutinde kullanılmamaktadır. Psikojenik purpura genellikle şizoid bozukluğu olan kişilerde, tuhaf bölgelerden kanamalarla seyreder. Hastanın tarif edilen kanamalara rağmen hemoglobin düzeylerinin stabil olması tipiktir. Bazı olgularda hiç kanama bulgusu olmadığı halde sekonder hemostaz testleri bozuk bulunabilir. Bu durumda öncelikle yanlış örneklemeden şüphelenilmelidir. FXII eksikliği ve lupus antikoagülanı varlığında aPTT uzundur, ancak kanama olmaz. Hatta lupus antikoagülanı olan olgularda tam tersine tromboz riski yüksektir (14,15,16).
PIHTILAŞMA BOZUKLUKLARINDA TEDAVİ
Pıhtılaşma bozukluklarında tedavi etyopatogeneze göre değişmektedir. Eğer sorun spesifik bir faktörün konjenital eksikliği ise, faktör preparatları ve taze dondurulmuş plazma ile tedavi yapılır. Karaciğer yetersizliği, yaygın damar içi pıhtılaşması sendromu gibi birden fazla faktörün eksikliği olan durumlarda etkenin ortadan kaldırılmasına yönelik (örneğin sepsiste antibiyotik tedavisi gibi) tedaviye ek olarak taze dondurulmuş plazma verilebilir. K vitamini eksikliğinde parenteral K vitamini verilmelidir. Spesifik faktör inhibitörü olan olgularda antikor yapımını azaltacak steroid ve immünsüpresif ilaçlar kullanılır. Lupus antikoagülanı in vitro bir fenomendir, in vivo trombotik süreç hızlanmıştır. Bu hastalara taze dondurulmuş plazma vermek, ölümcül trombozlara yol açabilir (14,15,16).
KAYNAKLAR
- Aird WC. Vascular bed-specific thrombosis. J Thromb Haemost 2007; 5 (Suppl 1): S283-S91. [Özet]
- Wagner DD, Frenette PS. The vessel wall and its interactions. Blood 2008; 111: 5271-81. [Özet] [Tam metin] [PDF]
- Sadler JE. Von Willebrand factor, ADAMTS-13, and thrombotic thrombocytopenic purpura. Blood 2008; 112: 11-8. [Özet] [Tam metin] [PDF]
- Diz-Küçükkaya R, Gushiken FC, Lopez JA. Thrombocytopenia. Lichtman, Beutler, Kipps, Seligsohn, Kaushansky, Prchal (eds): Williams Hematology. The McGraw-Hill Companies, New York, 2006; 1749-83.
- Handin RI. Inherited platelet disorders. American Society of Hematology, Educational Book 2005; 396-402. [Özet] [Tam metin] [PDF]
- Lopez JA, Andrews RK, Afshar-Kharghan V, Berndt MC. Bernard-Soulier syndrome. Blood 1998; 91: 4397-418. [Tam metin] [PDF]
- Belluci S, Caen J. Molecular basis of Glanzmann's thromboasthenia and current strategies in treatment. Blood Rev 2002; 16: 193-202. [Özet]
- Franchini M. Thrombotic microangiopathies: an update. Hematology 2006; 11: 139-46. [Özet]
- Zheng XL, Sadler JE. Pathogenesis of thrombotic angiopathies. Annu Rev Pathol Mech Dis 2008; 3: 249-77. [Özet][Tam metin] [PDF]
- Weksler BB. The pathophysiology of thrombocytopenia in hepatitis C virus infection and chronic liver disease. Aliment Pharmacol Ther2007; 26: 13-9. [Özet]
- Levine RL, Gililand DG. Myeloproliferative disorders. Blood 2009; 112: 2190-8. [Özet] [Tam metin] [PDF]
- Furie B, Furie BC. In vivo thrombus formation. J Thromb Haemost 2007; 5: 12-7. [Özet]
- Preston FE. Laboratory diagnosis of hereditery bleeding disorders: external quality assessment. Haemophilia 1998; 4: 12-8. [Özet]
- Hayward CPM. Diagnosis and management of mild bleeding disorders. American Society of Hematology, Educational Book 2005; 423-8. [Özet] [Tam metin] [PDF]
- Rodeghiero F, Tosetto A, Castaman G. How to estimate bleeding risk in mild bleeding disorders. J Thromb Haemost 2007; 5: 157-66. [Özet]
- Greaves M, Watson HG. Approach to the diagnosis and management of mild bleeding disorders. J Thromb Haemost 2007; 5: 167-74. [Özet]
- Wisloff F, Jacobsen EM, Liestol S. Laboratory diagnosis of the antiphospholipid syndrome. Thromb Res 2003; 108: 263-71.
Yazışma
Adresi: Prof.
Dr. Reyhan DİZ KÜÇÜKKAYA
İstanbul
Bilim Üniversitesi, İç Hastalıkları Anabilim Dalı, Hematoloji Bilim Dalı,
İSTANBUL
E-posta: rkucukkaya@hotmail.com